先立业,后成家,才是人生的正确顺序
2025-11-08 07:31:19
20种常见氨基酸和非蛋白质氨基酸

衍生物
非极性脂肪族R基氨基酸;非极性的,疏水的

甘氨酸(Gly,G)
(α-氨基乙酸)
唯一不含手性碳原子的氨基酸,不具有旋光性,结构最简单的氨基酸;
在肽链中它不与其他氨基酸残基的侧链发生作用,不会产生任何位阻现象,在空间结构的形成中有特定的作用。
很容易与非极性氨基酸成簇聚集在一起,但其侧链只是H原子,对疏水相互作用贡献不大,介于非极性和极性之间,有时甚至将它归入不带电荷极性类
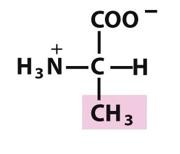
丙氨酸(Ala,A)
(α-氨基丙酸)
在蛋白质分子内倾向于成串聚集,借疏水相互作用稳定蛋白质的结构
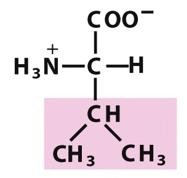
缬氨酸(Val,V)
(α-氨基-β-甲基丁酸)

亮氨酸(Leu,L)
(α-氨基-γ-甲基戊酸)

异亮氨酸(Ile,I)
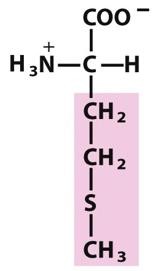
甲硫氨酸(蛋氨酸)
(Met,M)
两个含硫的氨基酸之一,侧链有一个非极性的硫醚基,是体内代谢中甲基的供体
侧链上的甲硫基是一个很强的亲核基团,与烃化试剂如甲基碘容易形成锍盐,反应可被巯基试剂逆转。在逆转反应中,原有的甲基和新加入的甲基除去的机会是相等的,因此当用14 C标记的甲基碘处理时,获得的蛋氨酸将有50%是同位素标记的。

脯氨酸(Pro,P)
(β-吡咯烷基-α-羧酸)
具有一个特殊的环状结构的脂族侧链,没有自由α-氨基,是一种α-亚氨基酸,后者可以看成是α-氨基酸的侧链取代了自身氨基上的一个H原子而成的杂环结构;脯氨酸和羟脯氨酸(还能溶于乙醇/乙醚中)
α-亚氨基酸参与形成的的肽键容易出现顺式构型。
Pro残基的二级氨基(亚氨基)处于刚性构象,此构象使含有Pro的多肽区域的结构柔性降低
4-羟脯氨酸(无密码子)
芳香族R基氨基酸;非极性的,疏水的
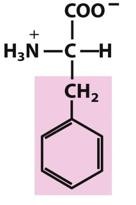
苯丙氨酸(Phe,F)
都参与疏水相互作用,都有吸收紫外光的能力,大多数蛋白质在280nm波长处具有特征性光吸收的原因,分光光度法是蛋白质含量的测定方法之一。
极性(Y的羟基,W的吲哚环氮)
:Y,W>F
吸收紫外光能力(旋光性)
:Y,W>F
血浆或尿中浓度的测定被用作苯丙酮尿症的诊断指标。

酪氨酸(Tyr,Y)
极性氨基酸
羟基能形成氢键,是某些酶的重要功能基
(不溶于水)
甲状腺素;
3,3’,5-三碘甲腺原氨酸;
磷酸酪氨酸;
腺苷酰酪氨酸
Tyr的酚基可与重氮化合物(氨基苯磺酸的重氮盐)结合成橘黄色化合物;
这是Pauly反应,可用于检测Tyr

色氨酸(Trp,W)
在植物和某些动物体内能转变成烟酸(尼克酸),是维生素PP的一种
侧链吲哚基在温和条件下可被N-溴代琥珀酰亚胺氧化。
此反应用于分光光度法测定蛋白质中色氨酸的含量,并能在色氨酸和酪氨酸残基处选择性地化学断裂肽键。
极性、不带电荷的R基氨基酸
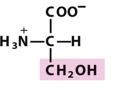
丝氨酸(Ser,S)
比非极性氨基酸在水中的溶解度大或亲水性大,含有能跟水形成氢键的官能团。
极性由羟基提供;在一个肽链折叠的蛋白质中它能形成内部氢键
含羟基,极性较小;在一些酶活性中心起作用
硒代半胱氨酸;
磷酸丝氨酸

苏氨酸(Thr,T)
磷酸苏氨酸

半胱氨酸(Cys,C)
极性来源于巯基,巯基是一个弱酸,能与O或N形成弱的氢键。
该-SH能在两条肽链之间的半胱氨酸残基间形成稳定的二硫桥。
Cys很容易氧化成成共价连接的二聚氨基酸,称为胱氨酸(无密码子,不溶于水),其中的两个Cys分子或残基通过二硫键/二硫桥连接在一起,二硫键连接的残基是强疏水的(非极性的)
1.巯基能打开乙撑亚胺,即氮丙啶的环,生成的侧链带有正电荷(),它为胰蛋白酶水解提供了一个新位点,这对氨基酸序列测定是很有用的。同时此反应也可用来保护肽链上的-SH基,以防被重新氧化为二硫键。
2.Cys可与二硫双-(硝基苯甲酸,DTNB,Ellman试剂)发生硫醇-二硫化物交换反应,1分子的Cys引起1分子的硫硝基苯甲酸的释放,它在pH8.0时,在412nm处有强烈的光吸收,可用分光光度法测定-SH基。
3.-SH基很容易受空气或氧化剂氧化,例如Cys-SH在空气中被氧化成Cys-S-S-Cys,二硫键在稳定许多蛋白质的结构方面起着特殊的作用。
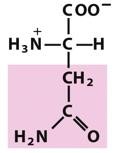
天冬酰胺(Asn,N)
极性由于酰胺基,这两个酰胺化合物在生理Ph(约7.0)范围内,其酰胺基不被质子化,因此侧链不带电荷。
Asn,Gln分别是Asp,Glu的酰胺,Asn,Gln很容易被酸或碱解成它们的游离氨基酸。

谷氨酰胺(Gln,Q)
带正电荷的(碱性)R基氨基酸
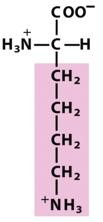
赖氨酸(Lys,K)
大多数的亲水R基氨基酸都是带正电荷或负电荷的。
在pH7.0时其R基具有净正电荷的氨基酸
在脂族侧链的ε位置上有第2个一级氨基;在pH7.0时侧链几乎完全带正电荷
5-羟赖氨酸;
6-N-甲基赖氨酸;
锁链素

精氨酸(Arg,R)
含有一个带正电荷的胍基,
在pH7.0时侧链几乎完全带正电荷
N-甲基精氨酸
侧链胍基在硼酸钠缓冲液(pH8~9,25~35℃)中,与1,2-环己二酮反应,生产稳定的缩合物;
此反应曾用于氨基酸序列分析以及蛋白质结构与功能的研究。
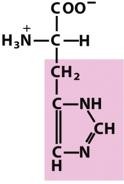
组氨酸(His,H)
有一个芳香族的弱碱性咪唑基。在pH7.0时侧链只有部分带正电。
在pH6.0时,His分子50%以上质子化,但在 pH7.0,质子化的分子不到10%。His是唯一一个R基的pKa(pKR)值在中性附近的氨基酸。
组氨酸起着质子供体/接纳体的作用(有还原性),使许多酶促反应变得容易发生,如丝氨酸蛋白酶类的催化部位中组氨酸所起的作用。
带负电荷的(酸性)R基氨基酸

天冬氨酸(Asp,D)
这两种氨基酸都含有两个羧基,并且第二个羧基在pH7.0左右也完全解离,因此分子带有净负电荷。

谷氨酸(Glu,E)
γ-羧基谷氨酸;
谷氨酸甲酯;
焦谷氨酸
β-丙氨酸
存在于肌肽和鹅肌肽中
是泛酸或称遍多酸(一种维生素)的一个成分
γ-氨基丁酸
由谷氨酸脱羧产生
它是传递神经冲动的一种化学介质,称神经递质
肌氨酸
是一碳单位代谢的中间物,
它和D-缬氨酸也是放线菌素D的结构成分
D-环丝氨酸
是一种链霉菌属细菌产生的抗生素,
能抑制细菌细胞壁的形成,被用作抗结核菌药物。
羊毛硫氨酸
它的内消旋体和外消旋体混合物可从羊毛的碱水解物中分离获得
它也是肽类抗生素枯草菌素和乳酸链球菌肽的组成成分。
甜菜碱
重要的代谢中间物
高半胱氨酸
高丝氨酸
L-瓜氨酸
它们是精氨酸生物合成和尿素循环的中间物。
L-鸟氨酸
还在各种组织和细胞中找到约200多种其他氨基酸。它们具有多种生物学功能,但都不参与蛋白质组成。这些氨基酸大多是上型a-氨基酸的衍生物。
但是有一些是β-,γ-或δ-氢基酸,并且有些是D型氨基酸。如细菌细胞壁的肽聚糖中发现有D-谷氨酸和D-丙氨酸;在一种抗生素短杆菌肽S中有D-苯丙氨酸。
这些非蛋白质氨基酸中有一些是重要的代谢中间物。
2025-11-08 07:31:19
2025-11-08 07:29:04
2025-11-08 07:26:48
2025-11-08 07:24:32
2025-11-08 06:57:35
2025-11-07 16:26:37
2025-11-07 16:24:21
2025-11-07 16:22:05
2025-11-07 16:19:49
2025-11-07 16:17:33
2025-11-07 16:15:17
2025-11-07 16:13:01
2025-11-07 16:10:45
2025-11-07 16:08:30
2025-11-07 16:06:14
2025-11-07 16:03:58
2025-11-07 16:01:42
2025-11-07 15:59:25
2025-11-07 15:57:10
2025-11-07 15:54:54